Traduzione dal sito : http://www.westonaprice.org/health-topics/abcs-of-nutrition/sulfur-deficiency/
L’obesità sta rapidamente diventando il numero uno problema di salute affrontare l’America di oggi, ed è anche salito a proporzioni epidemiche in tutto il mondo. La sua diffusione è associata all’adozione di una dieta di stile occidentale. Tuttavia, credo che il consumo diffuso di importazioni di prodotti alimentari prodotti da aziende statunitensi giochi un ruolo cruciale nella crescita dell’obesità in tutto il mondo. In particolare, questi “fast food” in genere includono i derivati fortemente trasformati di mais, soia e cereali, coltivate su mega-aziende agricole coltivate in modo intensivo . Inoltre, sosterrò in questo saggio che una delle cause principali alla base di obesità può essere la carenza di zolfo.
Lo zolfo è l’ottavo elemento più comune in massa nel corpo umano, dietro ossigeno, carbonio, idrogeno, azoto, calcio, fosforo e potassio. I due aminoacidi contenenti zolfo, metionina e cisteina, svolgono ruoli fisiologici essenziali in tutto il corpo. Tuttavia, lo zolfo è stato costantemente trascurato da coloro che affrontare le questioni di carenze nutrizionali. In effetti, la National Academy of Sciences non ha nemmeno assegnato un fabbisogno giornaliero minimo (MDR) per lo zolfo. Una conseguenza dello stato di limbo nutrizionale dello zolfo è che esso viene omesso dalla lunga lista di integratori che sono comunemente artificialmente aggiunti agli alimenti popolari come cereali.
Carenze non apprezzate.
Lo zolfo è trovato in un gran numero di alimenti, e, di conseguenza, si presume che quasi tutta la dieta soddisfi i requisiti minimi giornalieri. Ottime fonti sono le uova, cipolle, aglio, e verdure a foglia verde scure come cavoli e broccoli. Carni, noci, frutti di mare e contengono anche zolfo. La metionina, un aminoacido essenziale, si trova principalmente in albumi e pesce. Una dieta ricca di cereali come pane e cereali è probabile che sia carente di zolfo. Sempre più spesso, cibi integrali come il mais e la soia sono smontati in più parti con nomi chimici, e poi riassemblati in cibi fortemente trasformati. Lo zolfo è perso lungo la strada, e così è la consapevolezza che questa perdita comporta.
Gli esperti sono recentemente venuti a conoscenza che la deplezione (carenza) di zolfo nel terreno crea una grave carenza per le piante, indotte in parte da una maggiore efficienza nel settore agricolo degli Stati Uniti, che si è costantemente consolidato in mega-aziende agricole altamente tecnologizzate.
Si stima che gli esseri umani ottengono circa dieci per cento del loro approvvigionamento di zolfo dall’acqua potabile. Sorprendentemente, le persone che bevono acqua dolce hanno un aumentato rischio di malattie cardiache rispetto alle persone che bevono acqua più dura (ricca di sali minerali). Molte possibili ragioni sono state proposte per il motivo per cui questo potrebbe essere vero, e quasi ogni traccia di metallo è stato considerato come un possibilità. Tuttavia, credo che la vera ragione potrebbe essere semplicemente che l’acqua dura è più probabile che contenga zolfo.
Zolfo e tassi di obesità
La più abbondante fonte di zolfo è costituita dalla roccia vulcanica, principalmente di basalto, emessa dal nucleo della terra durante le eruzioni vulcaniche. Si ritiene generalmente che gli esseri umani si sono evoluti prima nella zona di rift africano, una regione che avrebbe goduto di una grande varietà di zolfo dovuta all’attività vulcanica pesante lì.
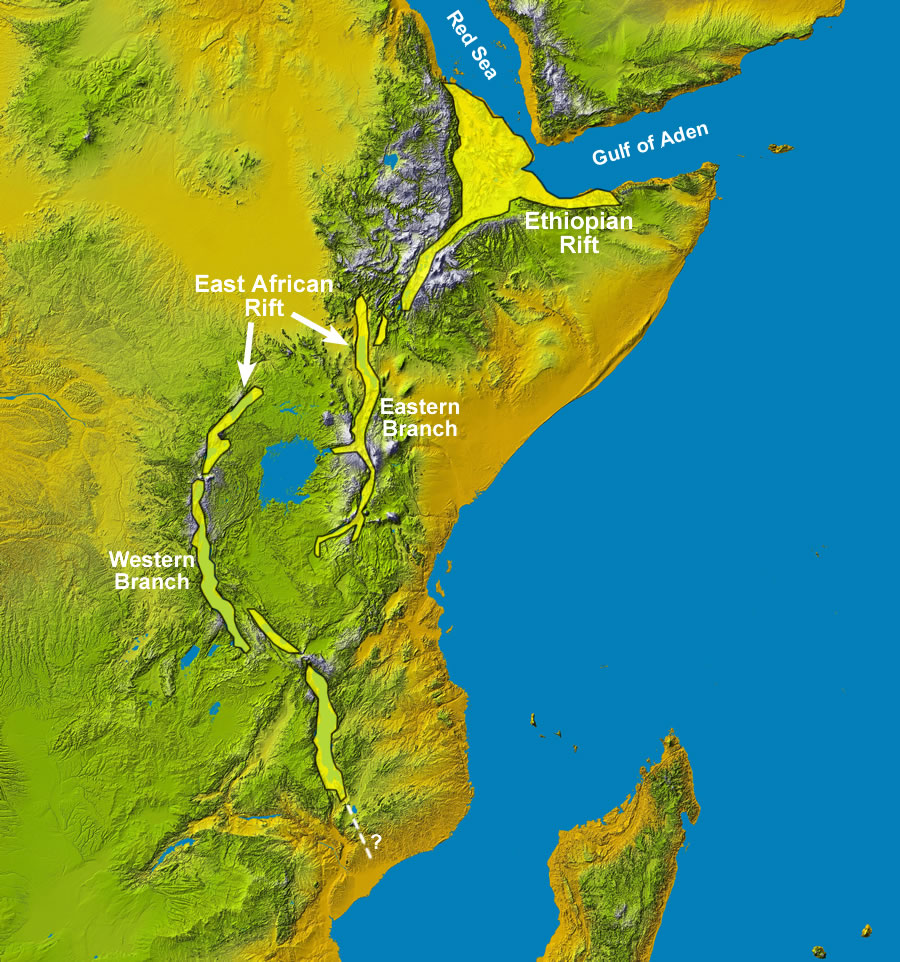
I tre principali fornitori di zolfo per le nazioni occidentali sono la Grecia, l’Italia e il Giappone. Questi tre paesi godono anche bassi tassi di malattie cardiache e obesità e una maggiore longevità. Negli Stati Uniti, Oregon e Hawaii, due stati con una significativa attività vulcanica, hanno tra i più bassi tassi di obesità nel paese. Al contrario, i tassi di obesità più alti si trovano nel Midwest e nel paese di fattoria del sud: l’epicentro delle pratiche agricole moderne (mega-aziende agricole) che portano alla deplezione di zolfo nel terreno. Tra tutti i cinquanta Stati, Oregon ha il più basso tasso di obesità infantile.
i giovani delle Hawaii stanno andando meno bene rispetto ai loro genitori, però: mentre Hawaii classifica come il quinto dal basso dei tassi di obesità, i suoi bambini di età compresa dieci attraverso diciassette pesano numero tredici. Come hawaiani sono di recente diventati sempre più dipendente dalle importazioni di prodotti alimentari dal continente, che hanno sofferto di conseguenza con maggiori problemi di obesità.
Nel suo libro di recente pubblicazione, The Jungle Effect , Dr. Daphne Miller dedica un intero capitolo all’Islanda . In questo capitolo lei si sforza di rispondere alla domanda del perché gli islandesi godono di tali tassi notevolmente bassi di depressione, pur vivendo ad una latitudine nord, dove ci si si aspetta un’alta incidenza di disturbo affettivo stagionale. Si sottolinea, inoltre, il loro eccellente record di salute in altri settori chiave: “Rispetto ai nordamericani, hanno quasi la metà del tasso di mortalità per malattie cardiache e diabete, molto meno l’obesità, e una maggiore aspettativa di vita. In realtà, il tasso di vita medio per gli islandesi è tra i più alti del mondo. “Mentre lei propone che il loro elevato consumo di pesce, con associato elevato apporto di grassi omega-3, possa essere plausibilmente il principale fattore benefico, sorvola il fatto che gli ex islandesi che si trasferiscono in Canada e continuando a mangiare un sacco di pesce non godono degli stessi diminuiti tassi di depressione e malattie cardiache.
A mio avviso, la chiave per la buona salute islandesi si trova nella serie di vulcani che compongono la spina dorsale dell ‘isola, che si trova in cima alla catena dorsale medio-atlantica. Dr. Miller ha sottolineato che l’esodo di massa verso il Canada era dovuto ad ampie eruzioni vulcaniche alla fine del 1800, che ricoprivano la regione sud-est coltissimo del paese. Questo significa, naturalmente, che i terreni oggi sono altamente arricchiti in zolfo. I cavoli, barbabietole e le patate che sono i cardini della dieta islandese stanno probabilmente fornendo molto più di zolfo per gli islandesi rispetto ai loro omologhi nella dieta americana forniscono.
Due molecole misteriose
Ora arriva la difficile domanda: perché la carenza di zolfo porterebbe all’obesità? La risposta, come gran parte della biologia, è complicata, e parte di quello che teorizzo è una serie di mie congetture.
Lo zolfo è conosciuto come un minerale di guarigione, e una carenza di zolfo porta spesso a dolore e l’infiammazione associata con vari e disturbi scheletrici e muscolari. Lo zolfo ha un ruolo in molti processi biologici, uno dei quali è il metabolismo. È presente nell’insulina, l’ormone essenziale che promuove l’utilizzo di zucchero derivato dai carboidrati per il carburante nelle cellule muscolari e adipose. Tuttavia, la mia vasta ricerca bibliografica mi ha portato a due molecole misteriose presenti nel flusso sanguigno e in molte altre parti del corpo: la vitamina D3 solfato e colesterolo solfato.
Dopo esposizione al sole, la pelle sintetizza vitamina D3 solfato, una forma di vitamina D che, a differenza della vitamina D3 non solfato , è solubile in acqua. Di conseguenza, può viaggiare liberamente nel sangue piuttosto che incapsulato all’interno dell’LDL (il cosiddetto colesterolo “cattivo”) per essere trasportata. La forma di vitamina D che è presente sia nel latte umano sia nel latte vaccino crudo è vitamina D3 solfato (la pastorizzazione la distrugge nel latte di mucca).
Il colesterolo solfato è anche sintetizzato nella pelle, dove forma una parte essenziale della barriera che trattiene i batteri nocivi e altri microrganismi come funghi. Il colesterolo solfato regola il gene di una proteina chiamata profilaggrina , interagendo come un ormone con il recettore nucleare ROR-alfa. La Profilaggrina è il precursore della filaggrina, che protegge la pelle dai organismi esterni. Una carenza di filaggrina è associata con l’asma e l’artrite. Pertanto, il colesterolo solfato svolge un ruolo importante nella protezione da asma e artrite. Questo spiega perché lo zolfo è un agente di guarigione.
Come la vitamina D3 solfato, anche il colesterolo solfato è solubile in acqua, ed anche, a differenza del colesterolo, non deve essere immagazzinato all’interno LDL per arrivare ai tessuti.
Qui mi pongo la domanda interessante: dove vanno la vitamina D3 solfato e il colesterolo solfato una volta che sono nel flusso sanguigno, e quale ruolo svolgono nelle cellule? Sorprendentemente, per quanto ne so, nessuno lo sa. È stato determinato che la forma solfatato di vitamina D3 è sorprendentemente inefficace per il trasporto del calcio, il noto ruolo di “primario” della vitamina D3. Tuttavia, la vitamina D3 ha chiaramente molti altri effetti positivi (sembra che se ne scoprano sempre di più ogni giorno), e questi includono un ruolo nella protezione del cancro, una maggiore immunità contro le malattie infettive, e la protezione contro le malattie cardiache. I ricercatori non hanno ancora capito come si esplicano questi benefici, che sono stati osservati empiricamente ma rimangono fisiologicamente inspiegabili. Tuttavia, ho il forte sospetto che è la forma solfato di questa vitamina che crei le condizioni per questi benefici, e le mie ragioni per questa convinzione saranno più chiari tra poco.
Una caratteristica molto particolare del colesterolo solfato, al contrario del colesterolo in sé, è che è molto agile: grazie alla sua polarità può passare liberamente attraverso le membrane cellulari, quasi come un fantasma. Ciò significa che il colesterolo solfato può facilmente entrare in un grasso o nelle cellule muscolari. Sto sviluppando una teoria che al suo interno propone un ruolo essenziale per il colesterolo solfato nel metabolismo del glucosio per fare da carburante in queste cellule. Qui di seguito, vi mostrerò come il colesterolo solfato può essere in grado di proteggere le cellule adipose e muscolari dai danni a causa di esposizione al glucosio, un agente riducente pericoloso, e di ossigeno, un agente ossidante pericoloso. Sostengo inoltre che, con insufficiente colesterolo solfato, le cellule muscolari e adipose vengono danneggiate, e come conseguenza non più in grado di elaborare il glucosio come combustibile. Questo accade prima alle cellule muscolari, ma alla fine per le cellule di grasso, pure. Le cellule di grasso diventano contenitori di stoccaggio dei grassi di fornire combustibile ai muscoli, perché i muscoli sono in grado di utilizzare il glucosio come combustibile. Alla fine, le cellule di grasso non riescono più nemmeno a rilasciare i loro grassi immagazzinati. Il tessuto adiposo si accumula quindi sul corpo.
Lo zolfo e metabolismo del glucosio
Al fine di comprendere la mia teoria, è necessario sapere di più su metabolismo del glucosio. Le cellule muscolari scheletriche e cellule adipose processano il glucosio in presenza di ossigeno nei loro mitocondri, e nel processo producono ATP, la “moneta” energetica base di tutte le cellule. Un trasportatore di glucosio chiamato GLUT4 è presente nel citoplasma delle cellule muscolari, e migra alla membrana cellulare dopo stimolazione dall’insulina. GLUT4 agisce essenzialmente come una chiave che apre la porta, lasciando il glucosio nella cellula, ma, come una chiave, funziona solo quando è inserito nella membrana.
Sia glucosio che ossigeno, a meno che non sono gestiti con cura, possono causare danni alle proteine e grassi della cellula. Il glucosio entra nella cellula all’interno di speciali siti ricchi di colesterolo nella parete cellulare chiamati lipidi rafts. La parete cellulare è costruita in questo modo per proteggerla dai danni, perché il colesterolo in più permette alle lipoproteine vulnerabili della parete cellulare di legarsi più strettamente e ridurre il rischio di esposizione (a glucosio e ossigeno) . Nelle cellule muscolari, la mioglobina è in grado di immagazzinare ossigeno supplementare, legato ad una molecola di ferro sicuro sequestrati in una cavità interna all’interno della proteina mioglobina.
Lo zolfo è una molecola molto versatile, perché può esistere in diversi stati di ossidazione distinte, che vanno da +6 (in solfato radicale) a -2 (in solfuro di idrogeno). Il glucosio, come un potente agente riducente, può causare notevoli danni di glicazione di proteine esposte, che porta alla formazione di AGEs che sono estremamente dannosi per la salute: si ritiene che siano un importante contributo per malattie cardiache. Ho ipotizzato che se lo zolfo (+6) è reso disponibile al glucosio come esca, il glucosio verrà deviato verso la riduzione dello zolfo anziché glicare alcune proteine vulnerabili come la mioglobina.
Nella ricerca sul Web, ho trovato un articolo scritto nel 1930 circa la capacità notevole del solfato di ferro, in presenza dell’agente ossidante perossido di idrogeno, di spezzare l’amido in molecole semplici, anche in assenza di enzimi per catalizzare la reazione. L’articolo ricorda che il ferro funziona molto meglio di altri metalli ed il solfato funziona molto meglio di altri anioni. Nel corpo umano, l’amido viene prima convertito in glucosio nel sistema digestivo. Le cellule muscolari e adipose devono solo dividere il glucosio. Così, il loro compito è più facile, perché il solfato di ferro sta cominciando da un prodotto intermedio composizione di amido, piuttosto che da amido stesso.
Da dove arriverebbe il solfato di ferro ? Sembra che il solfato di colesterolo, avendo oltrepassato la membrana cellulare, potrebbe trasferire il suo radicale solfato alla mioglobina, la cui molecola di ferro potrebbe fornire l’altra metà della formula. Nel processo, la carica della molecola di zolfo dovrebbe essere abbassata da +6 a -2, rilasciando energia e assorbire l’impatto degli effetti di riduzione di glucosio, e quindi serve come esca per proteggere le proteine nella cellula dai danni di glicazione.
Quando la cella è esposta all’insulina, i suoi mitocondri sono attivati per iniziare a pompare sia perossido di idrogeno e ioni idrogeno nel citoplasma, essenzialmente preparando per l’attacco dal glucosio. Se il colesterolo solfato entra nella cellula insieme al glucosio, poi tutti i giocatori sono disponibili.
Ipotizzo che il colesterolo solfato è il catalizzatore che costituisce il nutriente della parete cellulare (lipid raft) . Il solfato di ferro è quindi formato legando il ferro nell’unità eme in mioglobina ad uno ione solfato fornito da colesterolo solfato. Il colesterolo è lasciato alle spalle nella parete cellulare, arricchendo così la zattera lipidica (parte della membrana cellulare) in una nuova formazione con il colesterolo. Il perossido di idrogeno, fornita dai mitocondri dopo stimolazione di insulina, catalizza la dissoluzione del glucosio da parte del solfato di ferro. L’idrogeno pompato può accoppiarsi con lo zolfo ridotto (S-2) per formare solfuro di idrogeno, un gas che può facilmente diffondere indietro attraverso la membrana per un ciclo di ripetizione. L’ossigeno che viene rilasciato dal radicale solfato viene prelevato dalla mioglobina, sequestrato all’interno della molecola per viaggiare sicuro ai mitocondri. I prodotti di degradazione del glucosio e ossigeno vengono consegnati al mitocondri per completare il processo, che termina con acqua, anidride carbonica e ATP, il tutto mantenendo proteine citoplasmatiche della cellula salvo da glucosio e l’esposizione all’ossigeno.
Se ho ragione su questo ruolo per il colesterolo solfato sia nella nutrizione della zattera lipidica e nel fornire lo ione solfato, allora questo processo si rompe miseramente quando il colesterolo solfato non è disponibile. Prima di tutto, la zattera lipidica (lipid raft) non si forma. Senza la zattera lipidica, il glucosio non può entrare nella cellula. Un intenso esercizio fisico può permettere al glucosio di entrare nelle cellule muscolari anche in assenza di insulina . Tuttavia, ciò comporta l’esposizione pericolosa delle proteine della cellula alla glicazione (perché non c’è solfato di ferro per degradare il glucosio). La glicazione interferisce con la capacità delle proteine ‘a svolgere il proprio lavoro, e li lascia più vulnerabili ai danni dell’ossidazione. Uno dei più importanti proteine colpite sarebbe mioglobina: non sarebbe più in grado di svolgere efficacemente ossigeno ai mitocondri. Inoltre, mioglobina ossidata rilasciato nel flusso sanguigno da parte delle cellule muscolari storpi porta al conseguente insufficienza renale dolorosa e rabdomiolisi paralizzante, e possibile. Questa spiegazione potrebbe spiegare l’osservazione che la carenza di zolfo porta a dolori muscolari e infiammazioni.
La sindrome metabolica
La sindrome metabolica è un termine utilizzato per comprendere un complesso insieme di marcatori associati ad un aumentato rischio di malattie cardiache. Il profilo include (1) la resistenza all’insulina e metabolismo del glucosio nelle cellule muscolari disfunzionale; (2) eccesso di trigliceridi nel siero del sangue; (3) alti livelli di LDL, in particolare LDL piccole e dense, della peggior specie; (4) bassi livelli di HDL (il colesterolo “buono”) e contenuto di colesterolo ridotto all’interno delle singole particelle HDL; (5) Pressione sanguigna elevata; e (6) l’obesità, soprattutto l’eccesso di grasso addominale. Ho sostenuto in precedenza che questa sindrome è causata da una dieta che è ad alto contenuto di carboidrati vuoti (soprattutto fruttosio) e basso contenuto di grassi e colesterolo, insieme a un valore basso di vitamina D. Mentre io continuo a credere che tutti questi fattori certamente contribuiscono a questa sindrome, vorrei ora aggiungere un altro fattore così: insufficiente nutrizione di solfati nella dieta.
Ho descritto in un precedente saggio la mia interpretazione dell’obesità come condizione guidata da un bisogno di grasso nelle cellule per poter convertire il glucosio in grasso perché le cellule muscolari non sono più in grado di utilizzare efficacemente il glucosio come combustibile. Con la carenza di zolfo arriva la risposta al perché le cellule muscolari dovrebbero essere difettose nella gestione del glucosio: non possono venire con sufficiente solfato di colesterolo per nutrire la zattera di lipidi necessari per importare il glucosio.
Un modo alternativo per superare difettoso metabolismo del glucosio di una cellula muscolare è di fare un intenso esercizio fisico, in modo che il AMPK generato (un indicatore della carenza di energia) induce la GLUT4 migrare alla membrana anche in assenza di insulina . Una volta che il glucosio è all’interno cellule muscolari, tuttavia, il meccanismo di ferro-solfato appena descritto è disfunzionale, sia perché non c’è solfato di colesterolo e perché non c’è acqua ossigenata. Inoltre, con l’esercizio fisico intenso c’è inoltre un ridotto apporto di ossigeno, in modo che il glucosio devono essere trattati in condizioni anaerobiche nel citoplasma per la produzione di lattato. Il lattato viene rilasciato nel flusso sanguigno e spedito al cuore e cervello, entrambi i quali sono in grado di utilizzare come combustibile. Ma la membrana cellulare rimane impoverito di colesterolo, e questo rende vulnerabile al futuro danno ossidativo.
Un altro modo per compensare il metabolismo del glucosio difettoso nelle cellule muscolari è quello di aumentare di peso. Le cellule di grasso devono ora convertire il glucosio in grasso e rilasciarlo nel sangue come i trigliceridi, per alimentare le cellule muscolari. Nell’ambito di dieta lowfat, la mancanza dello zolfo aggrava il problema. La carenza di zolfo interferisce con il metabolismo del glucosio, quindi è una scelta molto più sana semplicemente per evitare fonti di glucosio (carboidrati) nella dieta; cioè per adottare una dieta molto povera di carboidrati. Poi il grasso nella dieta può fornire ai muscoli il carburante, e le cellule di grasso non sono gravati da dover conservare così tanto grasso di riserva.
L’insulina sopprime il rilascio dei grassi dalle cellule di grasso. Questo costringe le cellule di grasso a inondare il flusso sanguigno con trigliceridi quando i livelli di insulina sono bassi, cioè, dopo periodi prolungati di digiuno, come durante la notte. Le cellule di grasso devono scaricare abbastanza trigliceridi nel sangue durante il digiuno periodi per alimentare i muscoli quando l’approvvigionamento alimentare di carboidrati mantiene elevati livelli di insulina, e il rilascio dei grassi dalle cellule adipose è repressa. Mentre i carboidrati presenti nella dieta entrano, i livelli di zucchero nel sangue aumentano drammaticamente perché le cellule muscolari non li possono utilizzare.
Il fegato elabora anche il glucosio in eccesso in grasso, e li trasforma in LDL, per promuovere combustibile di approvvigionamento delle cellule muscolari difettose. Il fegato è così occupato con glucosio e fruttosio trasformazione in LDL, che tralascia la generazione di HDL, il colesterolo “buono”. Così il risultato è livelli elevati di LDL, trigliceridi, e di zucchero nel sangue, e ridotti livelli di HDL, quattro componenti principali della sindrome metabolica.
La presenza cronica di eccesso di glucosio e fruttosio nel flusso sanguigno porta ad una serie di problemi, tutti relativi a danni provocati dalla glicazione alle proteine del sangue dovuti all’esposizione al glucosio. Una delle proteine chiave che viene danneggiata è l’apolipoproteina, apoB, che è racchiusa nella membrana delle particelle LDL. La apoB danneggiata inibisce la capacità di LDL di fornire in modo efficiente i contenuti (di grassi e colesterolo) ai tessuti. Le cellule di grasso devono di nuovo venire in soccorso, pulendo le particelle di LDL rotte (attraverso un meccanismo che non richiede apoB essere in buona salute), tenendoli a parte, ed estraendo il loro colesterolo. Per funzionare correttamente, le cellule adipose devono avere intatta la proteina apoE, un antiossidante che pulisce il colesterolo ossidato e lo trasporta alla membrana cellulare per la consegna per particelle di HDL.
Le cellule di grasso, i macrofagi, e aterosclerosi
Mentre convertono diligentemente il glucosio in grassi immagazzinati, le cellule di grasso sono inondate di glucosio, che danneggia la loro apoE attraverso la glicazione . Una volta che il loro apoE è danneggiato, non possono più trasportare il colesterolo alla membrana. L’eccesso di colesterolo si accumula all’interno delle cellule adipose e alla fine distrugge la loro capacità di sintetizzare le proteine. Allo stesso tempo, le loro membrane cellulari diventano impoverito in colesterolo, in quanto non possono più fornire al membrane. Una cellula di grasso che si è deteriorata fino a questo punto non ha altra scelta che morire: esso invia segnali di pericolo che chiamano in macrofagi. I macrofagi consumano essenzialmente la cellula di grasso disfunzionale, avvolgendo la propria membrana intorno membrana della cellula di grasso che ora è a malapena in grado di inglobare il suo contenuto.
I macrofagi sono anche attori principali nelle striature di grasso che appaiono lungo i lati maggiori arterie che portano al cuore, e sono associati con l’accumulo di placca e malattie cardiache. In una serie di esperimenti affascinante, Ma ed altri (Yongjie Ma, Leyuan Xu, Daniel Rodriguez-Agudo, Xiaobo Li, Douglas M. Heuman, Phillip B. Hylemon, William M. Pandak and Shunlin Ren, “25-Hydroxycholesterol-3-sulfate regulates macrophage lipid metabolism via the LXR/SREBP-1 signaling pathway,” Am J Physiol Endocrinol Metab (2008) 295:1369-1379; doi:10.1152/ajpendo.90555.2008. 23. Martensson, J., and Meister,A., “Mitochondrial damage in muscle occurs after marked depletion of glutathione and is prevented by giving glutathione monoester.” Proc Natl Acad Sci U S A, (1989) 86:471-475 ) hanno dimostrato che lo ione solfato attaccato a forme ossidate di colesterolo è altamente protettivo contro striature di grassi e aterosclerosi.
In una serie di esperimenti in vitro, hanno dimostrato reazioni diametralmente opposte da macrofagi a 25-idrossile colesterolo (25-HC) contro la sua solfato colesterolo sulfoconjugate 25-idrossile (25-HC3S). Mentre 25-HC presente nel mezzo fa sì che i macrofagi sintetizzino e immagazzinino colesterolo e acidi grassi, 25-HC3S ha l’effetto opposto: promuove il rilascio di colesterolo al mezzo e fa sì che i depositi di grasso si riducano. Inoltre, mentre il 25-HC aggiunto al mezzo porta ad apoptosi e morte cellulare, 25-HC3S no. Suggerisco che il radicale solfato è essenziale per il processo che alimenta il colesterolo e ossigeno al muscolo cardiaco.
Malattie che portano alla degenerazione muscolare
Recentemente mi sono imbattuto in un interessante articolo in un numero del 1997 della rivista FASEB (Wulf Dröge and Eggert Holm, “Role of cysteine and glutathione in HIV infection and other diseases associated with muscle wasting and immunological dysfunction,” FASEB Journal (1997) Vol. 11, November, pp. 1077-1089.) che sviluppa una teoria convincente che bassi livelli sierici di sangue di due molecole contenenti zolfo sono una caratteristica di un certo numero di condizioni di malattia. Tutti questi malattie sono associate con atrofia muscolare, nonostante una nutrizione adeguata. Gli autori hanno coniato il termine “basso sindrome CG” per rappresentare questo profilo osservato, dove “CG” sta per l’aminoacido “cisteina,” e il tripeptide “glutatione”, entrambi i quali contengono un sulfidrilici radicale “SH”, che è essenziale alla loro funzione. Il glutatione è sintetizzato dal aminoacidi cisteina, glutammato e glicina, e le figure carenza glutammato nel processo di malattia e, come discuterò più avanti.
L’elenco delle condizioni di malattia associata alla sindrome bassa di CG è sorprendente e molto rivelatrice: l’infezione da HIV, il cancro, lesioni importanti, sepsi (avvelenamento del sangue), la malattia di Crohn (sindrome dell’intestino irritabile), colite ulcerosa, sindrome da stanchezza cronica e atletico sovrallenamento.
Questo documento riempie alcuni buchi mancanti nella mia teoria, ma gli autori non suggeriscono che la carenza di zolfo potrebbe in realtà essere un precursore allo sviluppo della sindrome bassa di CG. Credo che, in particolare per quanto riguarda la malattia di Crohn, sindrome da stanchezza cronica e l’esercizio fisico eccessivo, carenza di zolfo può precedere e provocare il fenomeno atrofia muscolare. La biochimica in questione è complicata, ma cercherò di spiegare in termini più semplici possibili.
Userò la malattia di Crohn come il mio obiettivo primario per la discussione: l’infiammazione dell’intestino, associato ad una vasta gamma di sintomi, tra cui riduzione dell’appetito, basso grado di febbre, infiammazione intestinale, diarrea, eruzioni cutanee, dolori alla bocca e gengive gonfie. Molti di questi sintomi suggeriscono problemi con l’interfaccia tra il corpo e il mondo esterno, per esempio, una vulnerabilità agli agenti patogeni invasivi. Ho detto prima che il colesterolo solfato gioca un ruolo cruciale nella barriera che mantiene gli agenti patogeni di penetrare la pelle. E logicamente svolge un ruolo simile ovunque vi sia la possibilità per i batteri di invadere, e certamente un’ottima occasione è disponibile presso la barriera endoteliale negli intestini. Così, ipotizzo che l’infiammazione intestinale e febbricola sono causa di un sistema immunitario iperattivo, resa necessaria dal fatto che gli agenti patogeni hanno un accesso più facile quando le cellule endoteliali sono carenti di colesterolo solfato. Le eruzioni cutanee e problemi di bocca e gengive sono una manifestazione di infiammazione in altre parti della barriera.
Ordinariamente, il fegato fornisce colesterolo solfato alla cistifellea, dove viene miscelato in acidi biliari, e successivamente rilasciato nel sistema digestivo per aiutare nella digestione dei grassi. Se una persona mangia costantemente una dieta lowfat, la quantità di colesterolo solfato consegnato al sistema digestivo dal fegato sarà ridotta. Ciò logicamente come risultato un sistema digestivo che è più vulnerabile all’invasione da patogeni.
Il solfato che è combinato con il colesterolo nel fegato è sintetizzato da cisteina, quindi insufficiente biodisponibilità di cisteina porterà ad una ridotta produzione di colesterolo solfato dal fegato. Ciò, a sua volta, rende difficile da digerire grassi, probabilmente, nel tempo, costringendo la persona di aderire ad una dieta lowfat. Sia la dieta basso contenuto di grassi o di carenza di zolfo viene prima, il risultato finale è una vulnerabilità agli agenti infettivi negli intestini, con una risposta immunitaria intensificata consequenziali.
Dröge illustra ulteriormente come una riduzione nella sintesi di solfato di cisteina nel fegato porta ad un aumento dell’attività di compensazione in un altro percorso biologico nel fegato, che converte il glutammato in arginina e urea. Il glutammato è molto significativo perché è prodotto principalmente dalla rottura di amminoacidi (proteine nei muscoli), per esempio, da atrofia muscolare. Le cellule muscolari vengono attivati cannibalizzare stessi al fine di fornire un’adeguata quantità di glutammato al fegato, principalmente, a mio avviso, per generare abbastanza arginina per sostituire il ruolo di solfato nel metabolismo del glucosio muscolare. (Queste attività nel fegato e nei muscoli sono circolari e si sostengono a vicenda.)
Arginina è la principale fonte di ossido nitrico (NO) e NO è la cosa migliore per il metabolismo del glucosio muscolare in assenza di colesterolo solfato. NO è un sostituto povero per SO4 -2, ma può funzionare in alcuni dei ruoli mancanti. Come ricorderete, propongo che il colesterolo SO4 -2 compie una serie di cose importanti nelle cellule muscolari: trasporta l’ossigeno alla mioglobina, fornisce il colesterolo alla membrana cellulare, che aiuta a rompere il glucosio, protegge le proteine della cellula da glicazione e danno ossidativo, e fornisce energia alla cellula. NO può aiutare a ridurre i danni glicazione, come l’azoto può essere ridotto 2-0 (mentre lo zolfo riduce da sei a -2). Inoltre fornisce ossigeno, ma non è in grado di trasferire l’ossigeno direttamente alla mioglobina legandosi con la molecola di ferro, come è il caso per solfato. NO non fornisce il colesterolo, in modo da deficit di colesterolo rimane un problema, lasciando proteine e grassi della cellula più vulnerabile ai danni ossidativi. Inoltre, non è di per sé un agente ossidante, così mioglobina è spenta, a causa sia dei danni provocato dalla ossidazione e dalla glicazione . La cellula muscolare, pertanto, si impegna in ossidazione mitocondriale del glucosio a suo pericolo: meglio tornare al metabolismo anaerobico del glucosio per diminuire il rischio di danni. Il metabolismo anaerobico dei risultati del glucosio in un accumulo di acido lattico, che, come spiegato in Dröge migliora ulteriormente la necessità per il fegato a metabolizzare glutammato, aumentando in tal modo l’anello di retroazione.
Inoltre, se ho ragione sul fatto che il colesterolo solfato costituisce il nutriente per i raft lipidici, con un deficit di colesterolo solfato, l’ingresso di entrambi glucosio e grassi nella cellula muscolare è compromessa. Questa situazione lascia la cella con poca scelta ma per sfruttare le sue proteine interne come combustibile, che si manifesta come l’atrofia muscolare.
In sintesi, un certo numero di diversi argomenti portano all’ipotesi che la carenza di zolfo provoca il fegato di passare da produrre colesterolo solfato a produrre arginina (e ossido di azoto in seguito). Questo lascia l’intestino e le cellule muscolari vulnerabili ai danni di ossidazione, che possono spiegare sia l’infiammazione intestinale e l’atrofia muscolare associata alla malattia di Crohn.
Il sistema immunitario dipende da una quantità di colesterolo abbondante per difendersi da forme di grave stress. Ho già sostenuto che il colesterolo alto nel siero è protettivo contro la sepsi. E ‘la pena di ripetere qui l’abstract da Critical Care che ha studiato i cambiamenti nei livelli di colesterolo nel sangue seguenti traumi, infezioni e insufficienza multiorgano: “ipocolesterolemia è un’osservazione importante dopo un trauma. In uno studio su pazienti traumatizzati in condizioni critiche, i livelli di colesterolo medi erano significativamente più bassi (119 ± 44 mg / dl) rispetto ai valori attesi (201 ± 17 mg / dl). Nei pazienti che sono morti, i livelli di colesterolo finali sono diminuite del 33 per cento rispetto a un aumento del 28 per cento nei sopravvissuti. I livelli di colesterolo sono stati negativamente influenzati da infezione o disfunzione del sistema d’organo “.
Pertanto, molte di queste condizioni / malattie che portano ad atrofia muscolare può farlo perché il colesterolo (e quindi colesterolo solfato) è diminuito nel siero del sangue. Il risultato è lo stesso ciclo di feedback tra il fegato e i muscoli che ho discusso quanto riguarda la malattia di Crohn. Penso che sia plausibile che l’atrofia muscolare associata a tutte queste condizioni sia causata da questo stesso meccanismo di feedback.
Ho discusso la riproduzione del ruolo di cisteina nel fornire solfato al fegato. Ma qual è il ruolo del glutatione, l’altra proteina contenente zolfo che è esaurita nella sindrome da basso GC ? Le cellule muscolari contengono normalmente livelli significativi di glutatione, e il suo esaurimento porta a danni mitocondriali nei pazienti . Il trauma chirurgico causa ridotti livelli di glutatione nei muscoli scheletrici dei pazienti. Si è tentati di ipotizzare che il solfato di colesterolo fornisce lo zolfo necessario per la sintesi del glutatione, in modo che la carenza sarebbe spiegata dalla ridotta disponibilità di colesterolo seguente alla risposta accresciuta del sistema immunitario a trauma chirurgico. Il glutatione è un potente antiossidante, quindi la sua carenza contribuirà ulteriormente alla disfunzione dei mitocondri delle cellule muscolari, quindi, compromettere notevolmente il suo approvvigionamento energetico.
Vi è una crescente consapevolezza che la deficienza di glutatione può giocare un ruolo in molte malattie. Se i problemi che sorgono sono solo a causa di insufficiente apporto di molecola di glutatione stesso o se un deficit più generale zolfo è la causa principale, è forse difficile da dire, ma provocatorio comunque.
IN CONCLUSIONE
I moderni stili di vita cospirano per indurre principali carenze del colesterolo solfato e vitamina D3 solfato . Siamo incoraggiati a evitare l’esposizione al sole e attivamente per ridurre al minimo assunzione di cibi di colesterolo-contenenti. Siamo incoraggiati a consumare un alto contenuto di carboidrati, dieta lowfat, che, come ho sostenuto in precedenza, porta ad un assorbimento di colesterolo alterato nelle cellule. Fortunatamente, correggere queste carenze a livello individuale è facile e semplice.
